研究急性人类免疫缺陷病毒(acute human immunodeficiency virus,简称HIV)是理解感染过程和识别长期共存病毒库(viral reservoir)建立机制的核心所在。从HIV病毒被发现到现在四十余年里,感染最初的数天到数周内,其早期靶标细胞仍不清楚。因为HIV感染早期的病人淋巴组织极难获取,因此,人类病毒传播(viral dissemination)途径和机制难以研究。
目前来说,这一领域的工作主要采用猴免疫缺陷病毒(simian immunodeficiency virus,简称SIV)感染非人灵长类(nonhuman primate)动物模型来研究。通过黏膜给药,SIV在黏膜处复制,并迅速建立了一组高度增殖的感染细胞池,并且在数天内传播到淋巴组织以及外周血中。SIV感染早期阶段的主要特征是血液和组织的CD4+T细胞深度清除,尤其是消化道。SIV感染进入慢行阶段后,SIV复制主要发生在消化道和淋巴节中。当然,SIV感染非人灵长类模型和HIV感染人类还是有明显区别的,而HIV在人类体内的扩散机制仍不清楚。
2023年2月17日,来自加拿大Universite ́ de Montre ́ al的Nicolas Chomont研究组在上发表题为HIV rapidly targets a diverse pool of CD4+ T cells to establish productive and latent infections的文章,就上述问题进行了深入研究。

作者之前的工作报道了人类早在II/II期Fiebig stages时到达淋巴结的HIV DNA的极限拷贝数。虽然学界对于在慢性HIV感染中,滤泡辅助性T细胞是病毒的首要靶标这方面了解较为完善,但是滤泡辅助性T细胞在HIV早期传播中的作用仍不清楚。因为感染细胞通常存活时间不超过两天,因此,在感染最初的数周内,这些最初感染细胞被迅速清除,并被新感染细胞所取代,从而罹患血浆病毒血症(plasma viremia)概率明显上升。
而在HIV感染最初阶段的淋巴组织和血液中,HIV从何处开始高度增殖感染,以及这些感染细胞在HIV传播过程中的功能都不清楚。
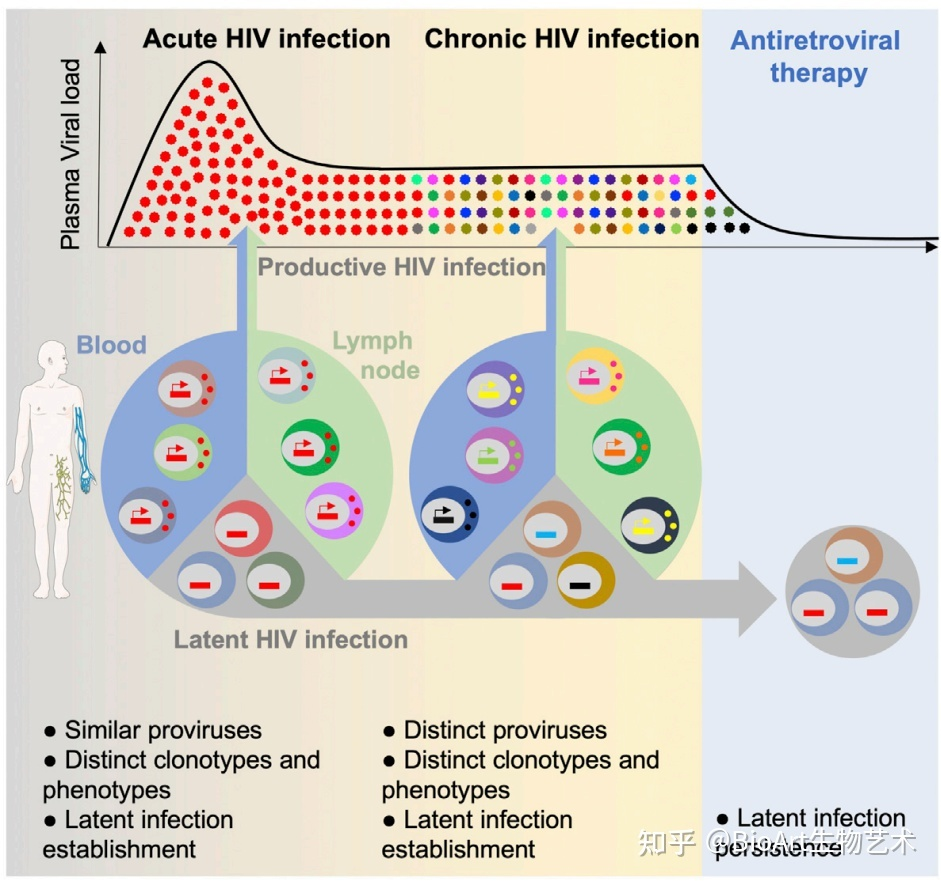
在HIV急性感染期,HIV病毒库通常以感染的CD4+T细胞出现,并且通过克隆扩增存在数年。他和这一HIV病毒库建立的分子和细胞机制也不清楚。在体外,活化的CD4+T细胞在一个相当短的时间空窗内进入静息期,并且易于被HIV病毒感染。一种可能的解释是,一类特殊的趋化因子可以提升静息T细胞易感性。有工作指出,在急性HIV感染并进行介入治疗时,就已经出现了病毒反弹(viral rebound)现象。当然,这时的基因组是否完整也不清楚。
作者通过基于单细胞的研究方法,在人类感染HIV的最早期,对血液和淋巴组织中的感染细胞进行表型分析和TCR测序。HIV首先会靶向一部分增殖中的、并且表面高表达CCR5的记忆性CD4+T细胞。这类感染细胞来源(血液、淋巴结)不同,表型也不尽相同。
感染细胞的TCR库具有强烈偏好性,基本上主要包括之前扩增和传播的克隆,这说明他们是相互独立感染过程的产物。在感染早期,潜在遗传性前病毒(Latent genetically intact provirus)就已经存在。因此,有效感染最初建立是基于一套表型和克隆型独特的T细胞池,与此同时,会产生潜在感染细胞。
综上所述,作者发现,在HIV急性感染时期,其早期靶标迅速变化,且血液和淋巴节中的靶标细胞存在明显差异。作者同时发现,HIV治疗过程中监测的潜在遗传性前病毒在急性感染的最早期就已经存在。
声明:本平台所发布资讯,如非特别注明,均来源于互联网的公开信息,仅做了少量修改,版权归属于著作权人。本平台所发布的咨询均用于免费的交流与学习,非商业用途。我们尊重著作权人的合法权益,如著作权人对本平台发布的内容有异议或涉及权利纠纷,请及时与我们联系,谢谢。



